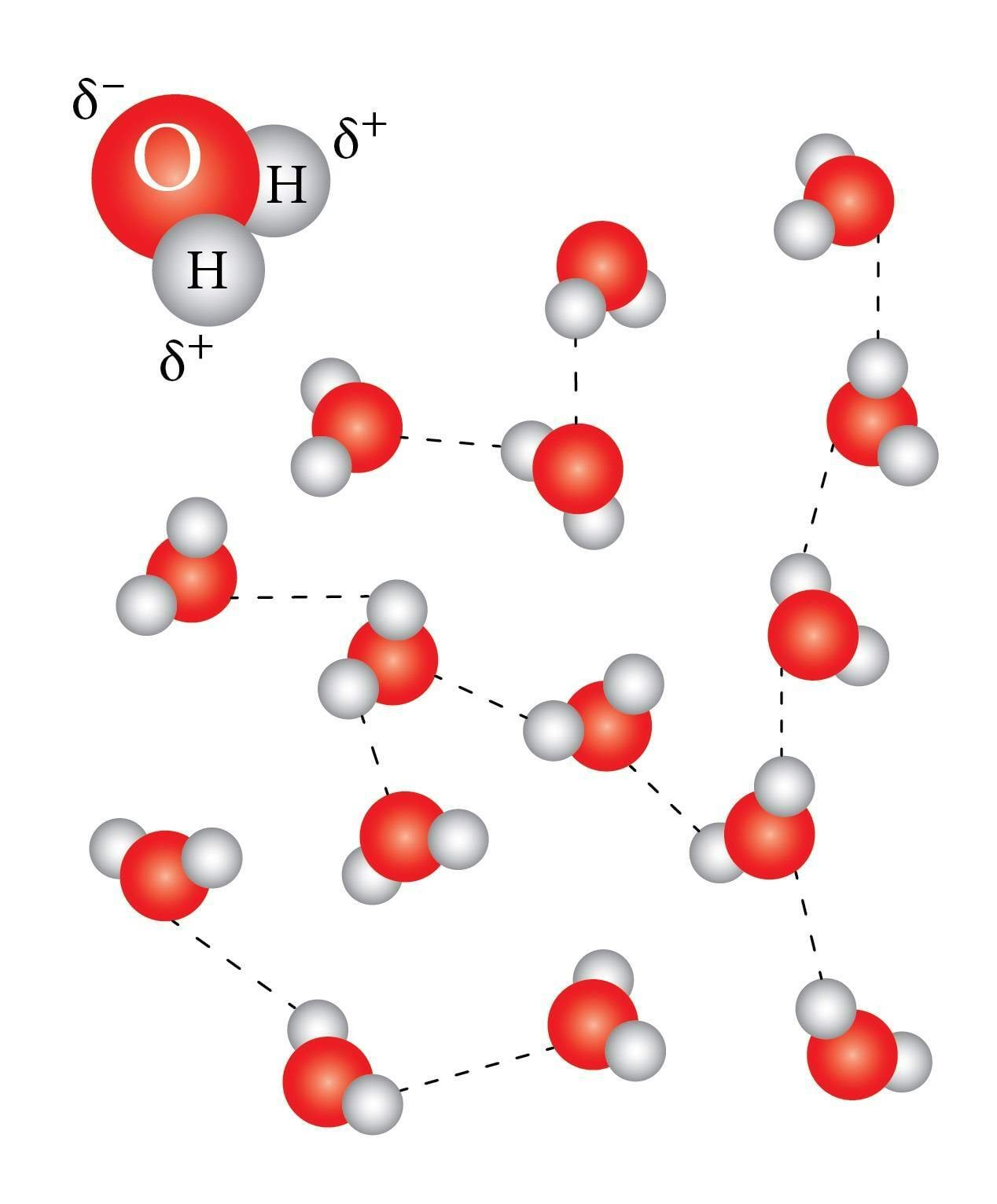
Vee molekul
Vee molekuli kuju (O-H sidemete vaheline nurk 104°) tingib molekuli polaarsuse. Piltlikult võiks öelda, et elektronid hoiavad rohkem hapniku kui vesiniku poole. Tervikuna neutraalses aatomis on seepärast vesinikud positiivse (δ+) ja hapnik negatiivse osalaenguga (2δ-). Nende erinimeliste piirkondade vahelise tõmbumise tõttu moodustuvad vesiniksidemed (tähistatud kriipsjoonega). Vedelas vees ei ole vesiniksidemed kuigi püsivad, nad katkevad pidevalt ja tekivad uued. Osa molekule, igal ajahetkel erinevad, on sel moel omavahel seotud.