Spektrijooned kui redel aatomimaailma
Aatomite spektrijooned ja energiatasemed
Optikakursuses õppisime, et kui hõrendatud gaasidest elektrivoolu läbi juhtida, kiirgavad need valgust, mille spekter on joonspekter. Teisisõnu, nende helendus ei sisalda igasuguse lainepikkusega valgust, vaid liitub teatavate kindlate lainepikkustega valgusvoogudest. Hõrendatud gaasides (nt elektrilahenduses läbi vesiniku, neooni, naatriumiauru jne) kiirgavad üksteist vähe mõjutavad üksikaatomid. Niisiis, joonspektrid on aatomite spektrid.
Kindlad lainepikkused tähendavad ka kindlaid sagedusi, sest sagedus
kus on valguse kiirus vaakumis ja lainepikkus. Kui meenutame valguse kaksisust (dualismi), taipame, et joonspekter tähendab ühtlasi seda, et aatomeist kiiratakse kindla energiaga footoneid. On ju footoni energia
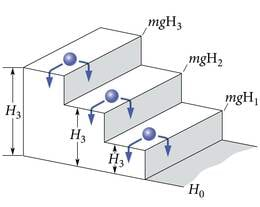
( on Plancki konstant). Kindla energiaga footonit kiirates peab aatom kaotama footoni energiaga võrdse energiaportsjoni (energia on jääv!). Samaviisi kaotab trepil astmelt astmele veerev kuulike (joon. 3.1) oma potentsiaalset energiat Maa raskusväljas hüpete ΔE1=mg(H3−H2), ΔE2=mg(H2−H1), ΔE3=mg(H1−H0) kaupa. Siin on – kuulikese mass, – raskuskiirendus, – astme kõrgus; , et seda ei aetaks segi Plancki konstandiga .
See hüppelisus viib mõttele, et aatomiski on elektronid kindlail energiatasemeil, mis püsivalt omased igale aatomiliigile (elemendile). (Meenutame spektraalanalüüsi – aatomite “sõrmejälgi”.) Nõndasamuti saame meiegi seista vaid redeli pulkadel, mitte nende vahel. Elektroni langedes kõrgemalt (suurema energiaga) tasemelt madalamale, kiiratakse valguskvant energiaga
kus ja on vastavalt kõrgema ja madalama taseme energia.
Siinkohal tuleks märkida, et aatomifüüsikas mõõdetakse energiat sageli süsteemivälistes ühikutes – elektronvoltides. Neis ühikuis väljenduvad mikromaailma energiakvantumid lühikeste, ülevaatlike arvudena.
Elektronvolt
elektronvolt () on energia, mille omandab elektron, läbides elektriväljas potentsiaalide vahet volt. 1eV=1,60⋅10−19J.
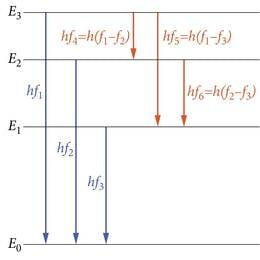
Analüüsides erinevate gaaside spektrijoonte paiknemist sagedusskaalal, leiame veelgi kinnitust kujutlusele energiatasemeist. Nimelt, kui spektris esinevad jooned sagedustel , , f3 jne, siis leiduvad samas spektris arutihti ka jooned, millele vastab sagedus f4=f1−f2, f5=f1−f3, f6=f2−f3. (sageduste kombinatsiooniprintsiip, tihti nimetatud ka tema märkaja, Šveitsi füüsiku Walter Ritzi (1878 - 1909) järgi Ritzi kombinatsiooniprintsiibiks).
Silmitsedes joonist 3.2, leiame, et kõik kombinatsioonid saavad lihtsa seletuse, kui footoneid kiiratakse elektroni “hüpetel” tasemelt tasemele , E2→E0 jne., nii et hf1=E3−E0, hf2=E2−E0, hf3=E1−E0, hf4=E3−E2 jne.
Allakäigutrepilt üles
Et kuulike saaks trepiastmeilt alla veereda, tuleb ta enne üles viia. Aatomi ja elektronide puhul ütleme: aatomit tuleb ergastada, talle energiat sisestada, et tal oleks, mida välja kiirata. Seda võib teha väga mitmel viisil, nt kiiritades aatomeid sobiva spektraalkoostisega valgusega või elektronkimbuga, ainet kuumutades jne. Kas aatomi elektronide energiatasemed avalduvad ka ergastamisel?
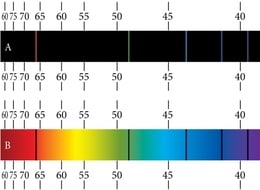
Meenutame optikast neeldumisspektreid, mis saadakse, kui pideva spektriga valgusallika valgus läbib nt. gaasi või auru. Tumedad neeldumisjooned neeldumisspektris langevad täpselt kokku heledate joontega kiirgusspektris (joon. 3.3). See näitabki, et aatomid saavad energiat ka vastu võtta üksnes kindlate portsjonite kaupa. Neelatavad energiakvantumid peavad vastama energiatasemete vahedele.
Franck-Hertzi katse
Aga mis siis, kui energiat ei loovuta footonid, vaid aatomitega põrkuvad elektronid? Sellele küsimusele saab vastust otsida joon. 3.4 visandatud katseriista abil.
Klaasballooni on joodetud 3 elektroodi: hõõgkatood , võre ja anood . Toru kaudu saab ballooni õhust tühjaks pumbata ja täita mitmesuguste gaaside või aurudega. Hõõgkatood kiirgab elektrone, mida kiirendatakse võrele antud positiivse pinge UKV ajel. Pinget UKV saab sujuvalt muuta (0...30V). Elektroodide ja vahele on rakendatud nõrk (∼0,5V) vastupinge UVA, mis võret läbinud elektrone pisut aeglustab.
Tõstame pinget UKV ja mõõdame anoodile jõudvate elektronide voolu IKA pikoampermeetriga pA. Kui balloonis on vaakum, kasvab vool sujuvalt (punktiir graafikul). Laseme ballooni pisut naatriumiauru (rõhuni umb. 1/1000 atmosfäärirõhust) ja kordame katset. Vool kasvab nüüd hoopis keerukamalt, perioodiliselt korduvate hüpetena. Kui esimene langus ilmub pingel , siis järgmine pingel 2U1, edasi 3U1 jne. Pinge jõudes -ni ilmub ballooni Na kollane helendus.
Mis toimub? Kui elektronide energia on väiksem kui E1=eU1, ei kaota nad energiat põrgetel Na-aatomitega, suudavad ületada vastupinget UVA ja jõuavad anoodile. Kuid pingel saavutatakse energia, mida Na-aatomid saavad elektronidelt põrgetel omastada. Aatomid ergastuvad ja hakkavad helenduma. Energiat kaotanud elektronid ei suuda enam ületada vastupinge “astangut”, pöörduvad võrele tagasi ja vool langeb järsult. Langused 2U1, 3U1 jne juures näitavad, et elektronid on saanud elektriväljalt piisavalt energiat , jne aatomi ergastamiseks.
Kriitiliste pingete väärtused sõltuvad ballooni täitvast gaasist/aurust: naatriumi puhul on U1∼2,1V, elavhõbeda aurus ∼4,9V, vesinikus ∼10,2V, heeliumis 20,6V. Energiad E1=eU1 on võrdsed kiirguvate footonite energiatega.
Neist katseist järeldub, et mitte ainult footonid, vaid ka mikroosakesed saavad loovutada aatomeile energiat ainult kindlate kvantumite viisi.
Seda katset tuntakse esmasooritajate, Saksa füüsikute James Francki (1882-1964) ja Gustav Hertzi (1887-1975) järgi Francki ja Hertzi katsena (1914).
Seaduspära vesiniku aatomi spektris
Meil on nüüd küllaldaselt tõendusmaterjali, et iga elemendi aatom võib asuda ainult talle omastel energiatasemetel. Energiat võtab ja annab aatom üksnes kindlate kvantumitena, mis võrduvad mingi kahe taseme energia vahega. Jääb küsimus, miks need tasemed kujunevad. Vihje vastuse leidmiseks annavad taas spektrid.
Võtame vaatluse alla lihtsaima, vesiniku aatomi spektri (joon. 3.5). Tundmatusse tungimist tuleb ikka alustada võimalikult lihtsast erijuhust, et vältida hägustavaid keerukusi, mis segavad tabamast peamist, põhilist.
Märkame seaduspära spektrijoonte asendeis: jooned on rühmitunud spektraalseeriatesse, igas seerias moodustavad jooned koonduvaid jadasid. Täppisanalüüs näitab, et kõiki seeriajadasid kirjeldab valem
kus on joone lainepikkus, R=1,0974×107m−1 on Rydbergi konstant, ning ja on täisarvud: on igas seerias konstantne täisarv (vt. tabel) ja n2=n1+1,n1+2,n1+3....
Valemi (3.1 ) koostas juba 1885 lihtsalt proovimismeetodil Šveitsi gümnaasiumiõpetaja Johann Balmer (1825–1898), siintoodud ülevaatliku ja lihtsa kuju andis Balmeri valemile rootslane Johannes Rydberg (1854–1919), tema nimest ka konstant .
Vesiniku spektraalseeriad
Seeria nimi avastaja | |||
Lymani seeria (1906) | Ultravalgus | ||
Balmeri seeria (1885) | Nähtav valgus | ||
Pascheni seeria (1908) | Infravalgus | ||
Bracketti seeria (1922) | Infravalgus | ||
Pfundi seeria (1924) | Infravalgus |
Rõhutasime sõna täisarvud. Kas kohtame lihtsat täisarvulist, diskreetset muutumist ka kusagil makrofüüsikas, kus üldiselt oleme harjunud kõigi suuruste ühtlase, sujuva varieerumisega?
Helisev pillikeel
Kui sõrmega või poognaga tõmmates viime pillikeele tasakaaluseisust välja, tekitame keeles laineid. Olenevalt puutekohast ja keele pingsusest, võivad need lained olla väga mitmesuguste pikkustega. Kõik lained on aga sulustatud keele kinnituskohtade vahele. Sulustatud lained teisenevad alati seisulaineteks, milles võnked toimuvad ainult paisudes, paigale jäävate sõlmede vahel. Levides keele kinnitisteni, peegelduvad lained nendelt tagasi. Keelel levivate ja kinnitiselt peegeldunud lainete interferentsist sünnivadki seisulained. Tõusuinterferentsis paisuda saavad ainult kindla pikkusega seisulained, sellised, mille poollaine pikkus mahub täisarv kordi keele pikkusele (joon. 3.6):
Ei saa tekkida seisulained, milles nt. 1,2⋅λ1=L: siis peaks ka kinnitatud keeleots võnkuma. Kõik lained, mille pikkus ei rahulda seost (3.2 ), kustuvad kiiresti leviva ja peegeldunud laine mõõnainterferentsil. Pikemalt kestma jäävad üksnes seisulained pikkusega λ=2L/n. Nende summa annabki keele helina: pikim, λ1=2L tekitab põhitooni, lühemad – ülemtoonid.
Olemegi leidnud täisarvulised suhted ning diskreetse, hüppelise muutumise ka makromaailmast: need ilmuvad seisulainete juures.